A partir de 2020, el cáncer colorrectal (CRC) fue el segundo tipo de cáncer más común diagnosticado y la tercera causa principal de mortalidad relacionada con el cáncer.
Al igual que la mayoría de los tumores sólidos, el CRC es en gran medida consecuencia de la acumulación progresiva de anormalidades en genes supresores de tumores y oncogenes, que inician y promueven secuencialmente la carcinogénesis.
Más del 90% de los CRC son adenocarcinomas. Al igual que muchos otros tumores sólidos, el CRC es una enfermedad heterogénea con diferentes subtipos que se distinguen por características clínicas y moleculares distintas. El CRC tiene su origen en el epitelio glandular (colonocitos) del intestino grueso. El proceso comienza con una aberración genética índice en el epitelio sano, lo que otorga a los colonocitos afectados una ventaja de crecimiento selectiva y la oportunidad de expansión clonal de células en ese sitio. Estas células luego proliferan en la mucosa del colon y finalmente se presentan como un pólipo.
La mutación inicial del CRC generalmente ocurre en el gen supresor de tumores APC, que se encuentra en el cromosoma 5. Este gen participa en varias funciones, incluida la supresión de la proliferación celular anormal. El silenciamiento o la inactivación de este gen resulta en un funcionamiento aberrante de la vía de señalización Wnt, una vía crítica y altamente conservada en la evolución de los animales que regula la comunicación celular, la división, la diferenciación y la transcripción génica.
Una mutación en APC suele ser un evento espontáneo en un sitio particular del colon, pero la anomalía cromosómica causante puede ser una mutación germinal heredada. Las mutaciones germinales crean un defecto de campo en todos los colonocitos, lo que expone todo el colon a un mayor riesgo de cáncer. La mutación germinal en APC es responsable del síndrome de poliposis adenomatosa familiar (FAP), un tipo raro de síndrome de predisposición hereditaria al cáncer caracterizado por cientos a miles de pólipos colorrectales precancerosos (pólipos adenomatosos) que, si no se eliminan, suelen resultar en CRC a una edad temprana.
La transformación desde una expansión inicialmente benigna de los colonocitos en entidades con crecimiento crecientemente perturbador requiere la adquisición secuencial de anormalidades genéticas adicionales. Esta acumulación de alteraciones moleculares establece un impulso de inestabilidad genética, lo que resulta en que las células afectadas desarrollen características cada vez más anormales que conducen finalmente a una transformación en cáncer invasivo.
La mayoría de los cánceres exitosos contienen muchas anormalidades genéticas. Se estima que se necesitan de 10 a 15 "impactos" (es decir, anormalidades) en vías de señalización clave para que un cáncer se establezca. Este proceso debe comenzar durante la corta vida útil de un colonocito normal. Cada anormalidad adquirida secuencialmente proporciona a las células afectadas una ventaja incremental de crecimiento que aumenta aún más la inestabilidad cromosómica y facilita el proceso neoplásico.
Los factores ambientales también son promotores establecidos de inestabilidad genética y se sabe que afectan la estructura y función de los genes. Estos factores pueden actuar como mutágenos directos o ejercer influencias adversas sobre la expresión génica. Además, la obesidad visceral, el tabaquismo, la falta de actividad física, el consumo de alcohol, los patrones dietéticos occidentales y las alteraciones en el microbioma del colon son promotores establecidos de la carcinogénesis. Todos estos factores epigenéticos influyen en la prevalencia de cánceres esporádicos y pueden ser responsables de conglomerados familiares que se pueden observar en ausencia de mutaciones germinales transmisibles. La mayoría de los cánceres ocurren en ausencia de antecedentes familiares, mientras que otros muestran agrupamientos familiares como se mencionó anteriormente.
Los conglomerados familiares de CRC pueden ser resultado de una mutación heredable en el germline, como el síndrome de poliposis adenomatosa familiar (FAP) y el síndrome de Lynch (cáncer colorrectal hereditario sin poliposis [HNPCC]), aunque una proporción sustancial aún son el resultado de mutaciones adquiridas, posiblemente impulsadas por exposiciones ambientales comunes u otras influencias epigenéticas. Los factores epigenéticos también desempeñan un papel en la expresión y penetrancia del cáncer en aquellos con una mutación genética identificable.
FIGURA 1:
Proporciones de cánceres colorrectales asociados con factores esporádicos y hereditarios
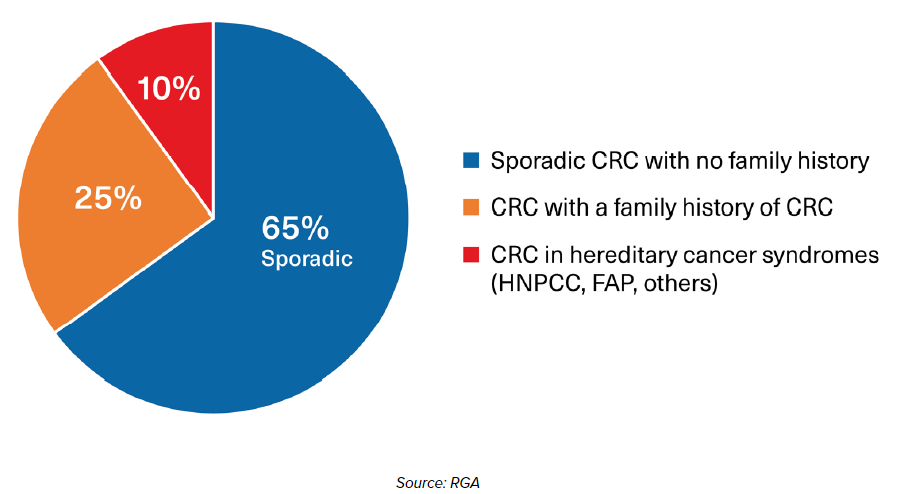
Un historial familiar de CRC aumenta considerablemente el riesgo individual de cáncer. De hecho, el riesgo de cáncer se duplica en aquellos con un familiar de primer grado afectado y se cuadruplica en aquellos con al menos dos familiares de primer grado afectados.
El epitelio normal del colon se renueva cada pocos días, ya que las células más viejas sufren apoptosis (muerte celular programada) y se desprenden. La tasa de proliferación celular del colon es del orden de 3 a 10 mil millones de células cada día, y esta alta renovación proporciona un enorme potencial para la acumulación de cambios genéticos y epigenéticos. El crecimiento y la división celular normales para la reparación de tejidos y el mantenimiento de órganos están regulados por señales de crecimiento determinadas genéticamente. Los protooncogenes promueven el crecimiento tisular mientras que los genes supresores de tumores inhiben la proliferación celular y la expansión del crecimiento. Las mutaciones en los protooncogenes, que causan su sobreexpresión, y las mutaciones en los genes supresores de tumores, que causan su silenciamiento, son promotores comunes de la tumorigénesis del colon.
El proceso de replicación del ADN que ocurre en la división celular es vigilado por un sistema de reparación de emparejamiento incorrecto del ADN (MMR, por sus siglas en inglés). Este sistema identifica y repara errores de traducción en el ADN recién sintetizado y limita las mutaciones materiales. Los defectos en el MMR promueven la supervivencia de mutaciones espontáneas, y también tienen un papel en la tumorigénesis que complementa el de los promotores del crecimiento. Los genes MMR son muy propensos a influencias epigenéticas.
Puede llevar años para que generaciones de células escapen de las múltiples capas regulatorias del cuerpo diseñadas para suprimir la carcinogénesis, y para que el epitelio normal se transforme en cáncer y adquiera potencial para invasión tisular y metástasis.
La Base Molecular del Cáncer Colorrectal
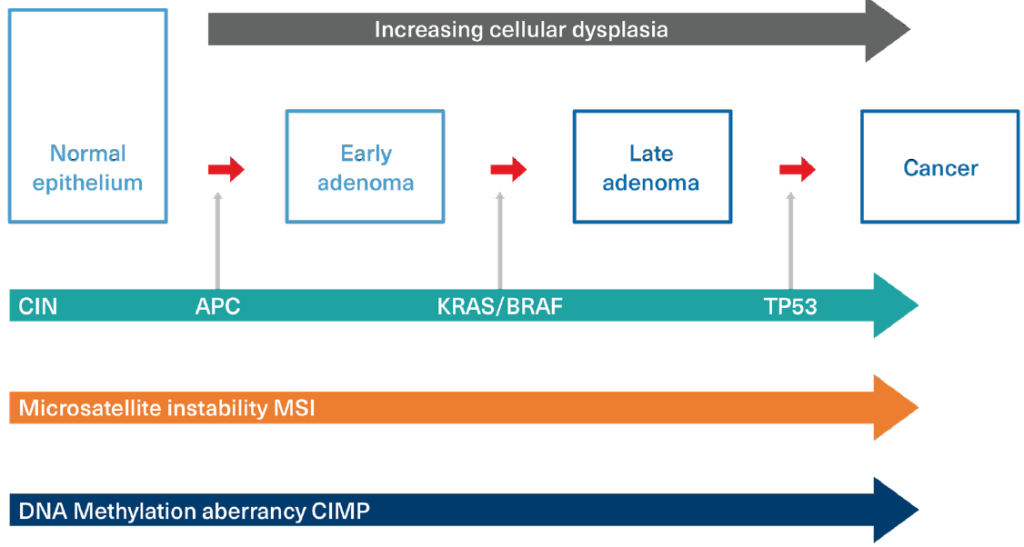
Al menos tres principales vías moleculares (fenotipos mutadores) forman la base para la iniciación y desarrollo del cáncer colorrectal (CRC). Cada una es activada o influenciada por aberraciones cromosómicas. Estas tres vías aún requieren la acumulación de defectos secuenciales, y las vías no son mutuamente excluyentes. (Figura 2)
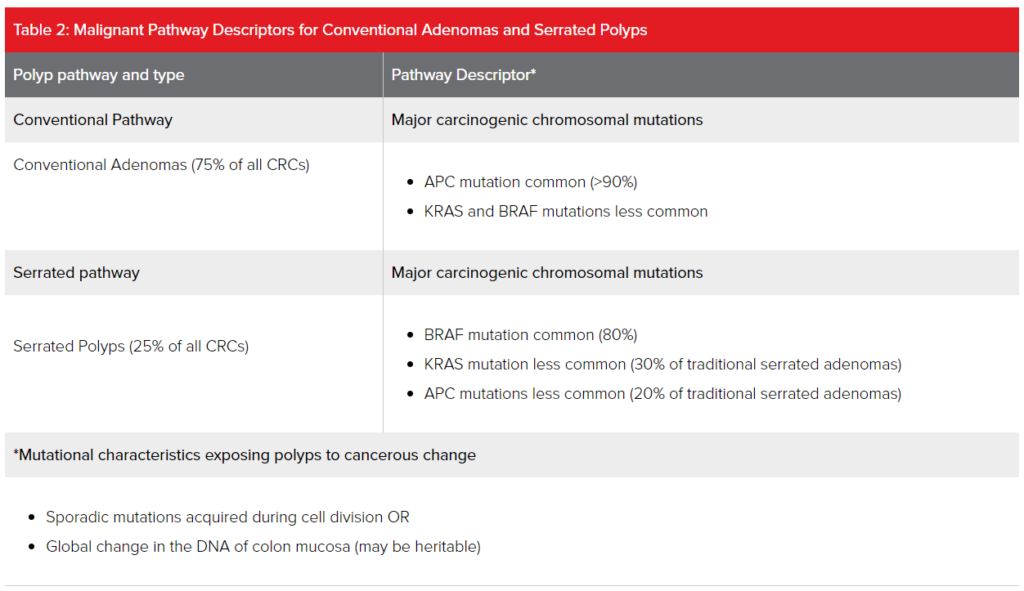
- Vía de Inestabilidad Cromosómica (CIN): La CIN es identificable en aproximadamente el 85% de los cánceres de colon esporádicos y se refiere a altas tasas de ganancias o pérdidas de porciones de cromosomas que afectan la expresión génica. Los tumores CIN se caracterizan por mutaciones en genes supresores de tumores (como APC), mutaciones oncogénicas de promotores de crecimiento (como KRAS y BRAF), y mutaciones en genes como TP53, que tanto inhiben la supresión tumoral como influyen negativamente en la apoptosis. Todas estas mutaciones representan ganancias en la función para el crecimiento de las células cancerosas.
En la vía de CIN, la vía del cáncer comúnmente se inicia por la inactivación del gen supresor de tumores APC, promovida por la aparición temprana de una mutación en el promotor de KRAF o BRAF, y luego se ve potenciada por la adquisición posterior de una mutación en TP53.
APC mutations se han identificado en hasta un 90% de los casos esporádicos de CRC. En los grupos familiares del síndrome de poliposis adenomatosa familiar (FAP), por ejemplo, todos heredan una copia mutada del gen supresor de tumores APC. - Vía de Inestabilidad de Microsatélites (MSI): MSI es otro tipo de inestabilidad cromosómica. Se refiere a la presencia de un alto número y frecuencia de errores muy pequeños de replicación en el ADN dispersos por todo el genoma. La acumulación progresiva y repetitiva de estos errores en una secuencia de ADN conduce a una deficiencia en el sistema de reparación de emparejamiento incorrecto (MMR), lo que promueve un aumento dramático en los errores de mutación. MSI se identifica en el 15%-20% de los casos esporádicos de CRC y es responsable del síndrome de Lynch o HNPCC.
- Vía de Metilación Anormal del ADN: No todos los genes se expresan en todo momento. La metilación del ADN juega un papel crucial en la expresión génica y es una herramienta de señalización que puede utilizarse para bloquear genes en posición activada o inactivada. Los sitios de metilación están distribuidos por todo el genoma en lo que se llaman islas CpG. La metilación en estos sitios puede cambiar la expresión del gen y conducir al silenciamiento génico. El silenciamiento inapropiado, especialmente de genes supresores de tumores, puede promover la carcinogénesis. Un fenotipo anormal de Methylator de Islas CpG (CIMP) es demostrable en hasta un 30%-35% de los casos esporádicos de CRC y es una característica de los tumores que se desarrollan en pólipos con una morfología serrada (discutida más abajo). Los tumores CIMP positivos están comúnmente asociados con mutaciones en KRAS y BRAF y a menudo muestran inestabilidad de microsatélites.
FIGURA 2:
RUTAS MOLECULARES HACIA EL CÁNCER
Nomenclatura y Clasificación de los Pólipos y el Riesgo de Transformación Maligna
La adquisición de características de promoción del crecimiento en los colonocitos resulta en el desarrollo de crecimientos benignos que se expanden y protruyen en el lumen intestinal en forma de pólipos. Aunque más del 90% de los adenocarcinomas se desarrollan en pólipos benignos, la mayoría de los pólipos no albergan ni adquieren las mutaciones carcinogénicas secuenciales necesarias que promueven la transformación en malignidad manifiesta.
La clasificación, terminología y criterios diagnósticos aplicados a los pólipos continúan evolucionando, particularmente en lo que respecta a su biología molecular y potencial de cambio maligno. La comprensión de las diversas vías genéticas que inducen y promueven la transformación cancerosa es fundamental para la gestión de pólipos y ha llevado al desarrollo de estrategias de intervención que han reducido la incidencia y mortalidad del cáncer colorrectal.
La clasificación más reciente de pólipos colorrectales aparece en la Clasificación de Tumores del Sistema Digestivo de la Organización Mundial de la Salud (OMS), 5ª edición, publicada en 2019.
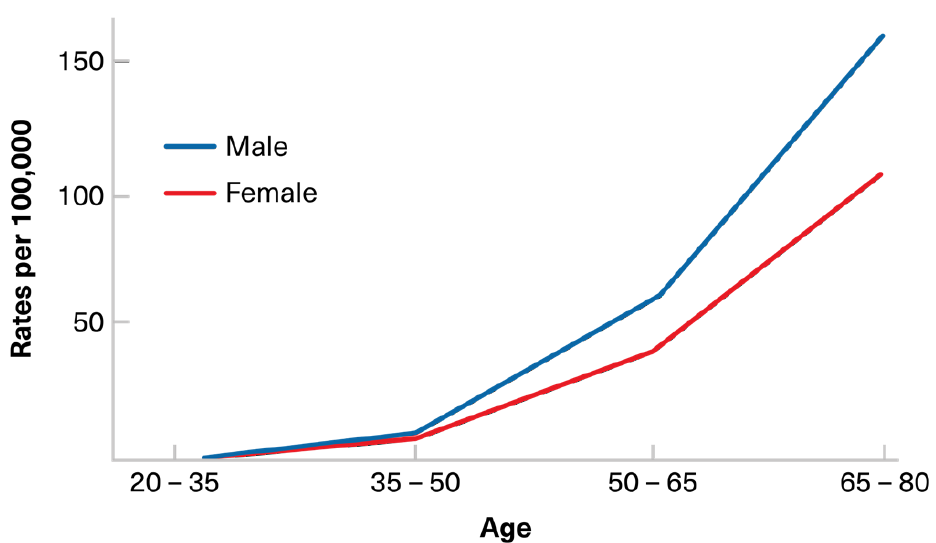
La prevalencia de pólipos benignos aumenta con la edad. Un aumento significativo generalmente comienza entre los 40 y 50 años, precediendo la incidencia relacionada con la edad del cáncer colorrectal invasivo (Figura 3). En los pólipos destinados a la transformación maligna, la secuencia de un precursor benigno a un cáncer generalmente ocurre durante varios años, con este período de latencia proporcionando una oportunidad ideal para la detección temprana a través de exámenes de cribado.
FIGURA 3:
INCIDENCIA DEL CÁNCER DE COLÓN POR EDAD – MUNDO.
Tras la detección y extracción de un pólipo índice, los intervalos de vigilancia posteriores se rigen por:
- Tamaño (el umbral de tamaño avanzado se define como 10 mm)
- Número encontrado (definido como >3)
- Clasificación (determinada por histología)
- Presencia o ausencia de cualquier característica displásica (determinada por histología)
Descriptores morfológicos
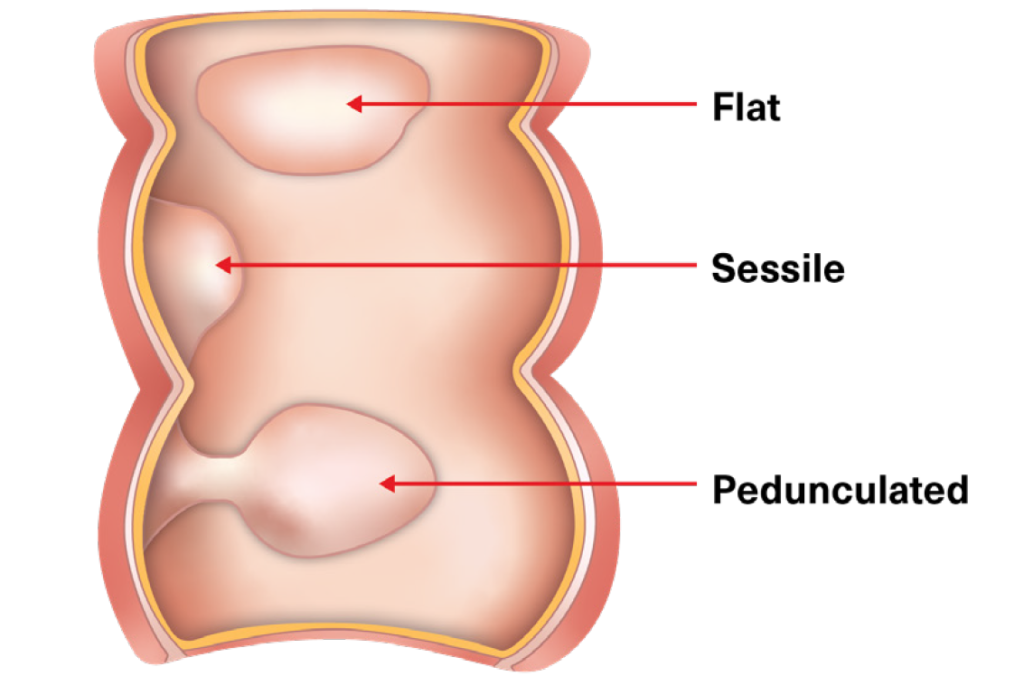
Se utilizan dos términos para describir la apariencia visual general de los pólipos encontrados durante una colonoscopia: pediculados (pólipos con un tallo) y sésiles (pólipos que tienen una base ancha o son planos, sin tallo).
Estas características generales no permiten determinar el riesgo de malignidad. La extracción endoscópica suele ser más fácil para los pólipos pediculados que para las lesiones sésiles grandes.
Esa salvedad se reconoce en algunas de las pautas de vigilancia de seguimiento que se discutirán a continuación.
FIGURA 4:
PÓLIPOS PEDICULADOS Y SÉILES
Clasificaciones Histológicas
Dos tipos de pólipos, adenomas convencionales y pólipos serrados, se definen utilizando dos características histológicas distintas. Ahora se sabe que estas características se alinean con diferentes vías hacia la carcinogénesis.
Los adenomas convencionales (anteriormente conocidos como adenomas o pólipos adenomatosos) son el tipo más común. Representan la lesión precursora clásica del cáncer y son responsables de la mayoría de los CRCs (cáncer colorrectal).
Los pólipos serrados (anteriormente conocidos como pólipos hiperplásicos o pólipos metaplásicos) son menos comunes y, tradicionalmente, no se consideraban precancerosos. Ahora se pueden clasificar en subconjuntos histológicos sobre la base de perfiles morfológicos y moleculares que etiquetan a algunos como con potencial maligno. El término “pólipo serrado” ahora abarca una serie de entidades, a menudo con diferencias sutiles en la arquitectura que pueden ser difíciles de distinguir. Los pólipos hiperplásicos (HP), actualmente considerados un subconjunto de pólipos serrados, son el tipo más común de pólipo serrado (75%) y tienen el menor potencial de malignidad.
TABLA 1:
TIPOS DE PÓLIPOS - Descriptores
| Conventional adenomas | Serrated polyps |
| Represent approximately 70% of all polyps | Represent approximately 30% of all polyps |
| Defined by a “layered” appearance of epithelial cell growth | Defined by a “serrated” or “sawtooth” appearance of epithelial cell growth |
| APC gene mutation is common (>90% of all adenomas) | Most remain classifiable as HPs with little or no malignant potential |
| All have malignancy potential | Premalignant subsets of serrated polyps are now recognized |
| Malignancy develops via a conventional pathway | BRAF (or KRAS) gene mutation is common in premalignant subsets (75%-90%) |
| Malignancy risk is 10% | Malignancy develops via a “serrated pathway” |
| Account for 85% - 90% of all sporadic CRC cases1 | Account for 10% - 15% of all sporadic CRC cases1 |
FIGURA 5:
HISTOLOGÍA – Pólipos adenomatosos y serrados
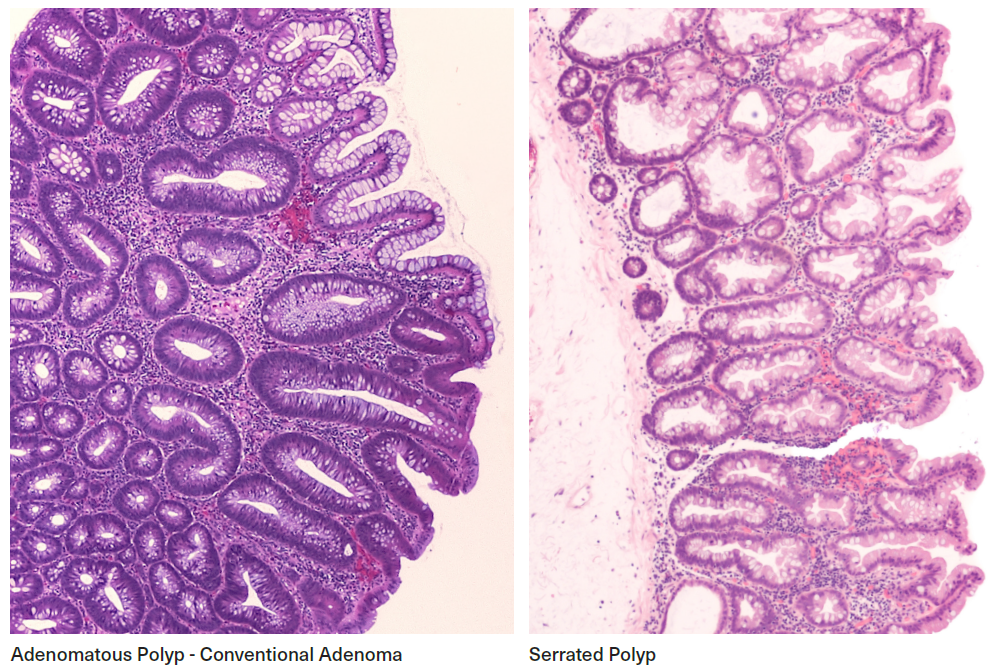
Descripción y Nomenclatura
Adenomas convencionales
Los adenomas convencionales son el tipo más común de pólipo de colon. El término "adenoma convencional" es la nomenclatura actual en las guías de vigilancia y ha reemplazado los términos antiguos "pólipo adenomatoso" y "adenoma" para distinguirlo de los adenomas que ahora se describen en las clasificaciones de lesiones serradas. (La nomenclatura antigua aún puede encontrarse en algunos informes de patología.)
La mayoría de los cánceres surgen en adenomas convencionales y progresan a través de una secuencia bien descrita de "adenoma-carcinoma". Aunque solo el 10% de los adenomas convencionales se transformarán en malignidad, la mayoría albergan mutaciones en el gen supresor de cáncer APC, un guardián importante contra el CCR. Las mutaciones en APC están altamente asociadas tanto con el desarrollo de adenomas convencionales como con la transformación maligna. Esta transformación puede reflejarse en diferentes grados de displasia observados en microscopía.
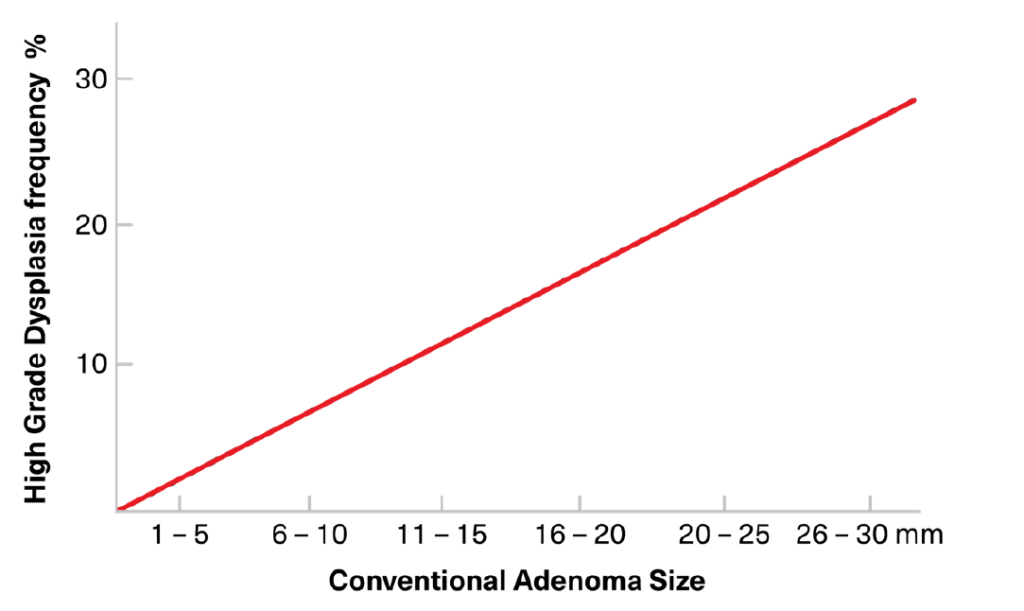
Los adenomas convencionales son los pólipos precursores en la mayoría de los CCR esporádicos y familiares, así como en aquellos asociados con los síndromes hereditarios FAP y HNPCC. En el CCR esporádico, las mutaciones en APC se adquieren espontáneamente en células somáticas, con malignidad manifiesta desarrollándose solo después de un largo período de otras aberraciones genéticas secuenciales, influenciadas por factores epigenéticos. En los cánceres familiares, las mutaciones en APC pueden transmitirse a través de la línea germinal, y la mayoría de estos adenomas son pedunculados y pequeños. La mayoría de los adenomas convencionales se agrupan en el colon distal (izquierdo), y son comunes en la región rectosigmoidea. El tamaño más grande del adenoma se asocia con una mayor prevalencia de displasia y malignidad (Figura 6). Los pólipos <10 mm raramente son malignos, y cualquier cambio canceroso puede tardar hasta 10 años en desarrollarse. Sin embargo, los pólipos >10 mm tienen más probabilidades de albergar cáncer, y los pólipos benignos de ese tamaño pueden transformarse en cáncer en un período de dos a cinco años.
FIGURA 6:
Relación entre el tamaño del adenoma convencional y la probabilidad de presencia de displasia de alto grado
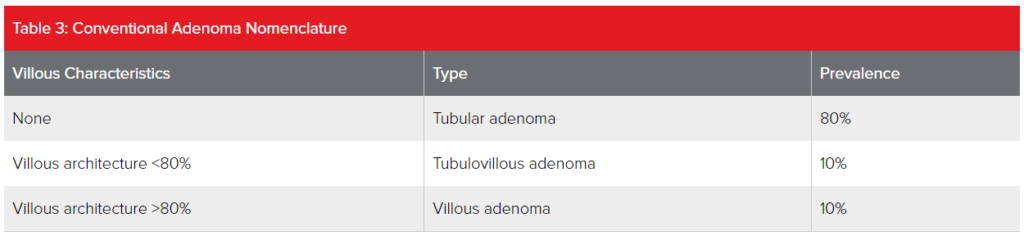
Los adenomas convencionales suelen tener una superficie lisa, pero algunos contienen componentes de una arquitectura vellosa o similar a frondas. Estos dos tipos se denominan "adenomas convencionales lisos" y "adenomas convencionales vellosos", respectivamente. Los adenomas sésiles son más propensos a contener componentes vellosos que los adenomas pedunculados.
Los adenomas convencionales se subclasifican según el grado en que exhiben arquitectura vellosa. Aunque esto introduce otra capa de complejidad en la nomenclatura, se ha argumentado que es importante debido a su potencial de malignidad.
Tradicionalmente, la arquitectura vellosa en los pólipos serrados se ha considerado un predictor independiente del riesgo de cáncer y muerte. Aunque datos recientes sugieren que el riesgo puede no ser tan alto como se pensaba anteriormente, la mayoría de las directrices de vigilancia mantienen protocolos específicos para los vellosos. Sin embargo, la Sociedad Europea de Endoscopia Gastrointestinal (ESGE, por sus siglas en inglés) hace recomendaciones en sus directrices independientemente de los componentes vellosos.
Pólipos serrados
Los pólipos serrados son menos comunes que los adenomas convencionales y su terminología sigue evolucionando. La mayoría son sésiles (planos o ligeramente elevados sin tallo). Los pólipos serrados son responsables de aproximadamente el 20% de los cánceres esporádicos, aunque la mayoría de estos pólipos no se vuelven cancerosos. La prevalencia de pólipos serrados es del 20%-40% en individuos de riesgo promedio, siendo la mayoría hiperplásicos.
Los pólipos serrados tienden a aparecer a edades más tempranas que los adenomas convencionales. Aunque la prevalencia aumenta constantemente con la edad, no parece tener un aumento tan pronunciado con la edad como los adenomas convencionales. Aunque anteriormente se consideraba que representaban una población benigna y homogénea, el reconocimiento de que esta categoría de pólipos contiene algunas entidades que portan mutaciones precursoras de cáncer ha resultado en la descripción de tres subtipos principales. En 2019, la OMS amplió el número de subtipos para estratificar mejor el espectro de riesgo de malignidad asociado y en reconocimiento de las dificultades que a veces se experimentan en el examen histológico. Estos son:
- Pólipos hiperplásicos (HP): Estos eran conocidos como pólipos metaplásicos en la nomenclatura antigua.
- Adenomas serrados sésiles (SSA) o pólipos serrados sésiles (SSP) o lesiones serradas sésiles (SSL).
- SSA/SSP/SSL con displasia.
- Adenomas serrados tradicionales (TSA) (también conocidos como pólipos serrados tradicionales).
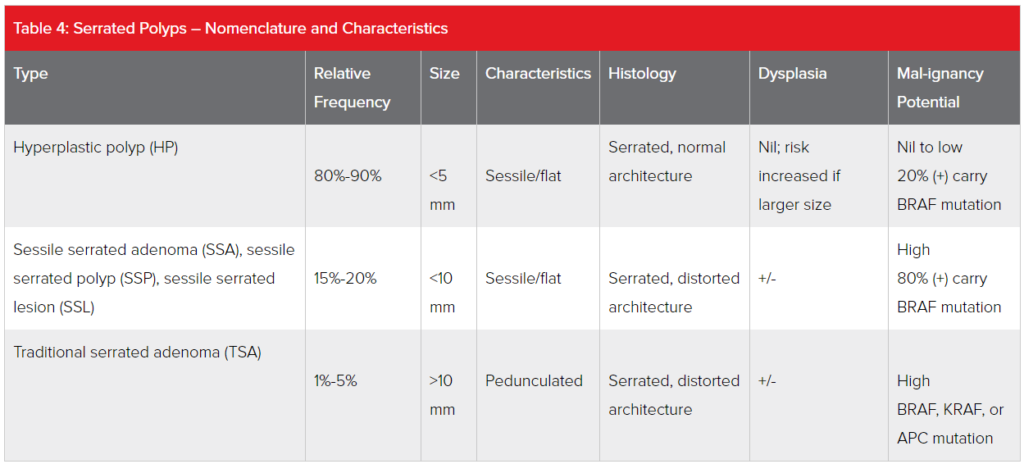
La vía hacia el cáncer en los pólipos serrados, conocida como la vía serrada, es diferente de la de los adenomas convencionales. Las mutaciones en el gen BRAF son comunes tanto para SSA/SSP/SSL como para TSA, y estas lesiones se consideran de alto riesgo de desarrollar cáncer colorrectal. La prevalencia del gen oncogénico es mucho menos común en HP. La expresión génica está nuevamente influenciada por factores epigenéticos como el tabaquismo, la diabetes tipo 2, el consumo de alcohol y factores dietéticos como el consumo de carne roja.
SSA/SSP/SSL comienza a aparecer en la mucosa del colon derecho tan temprano como en la tercera década de vida, se vuelve clínicamente significativo alrededor de los 50 años y luego la incidencia aumenta rápidamente entre los 55 y 70 años. Los aumentos en la incidencia de SSA/SSP/SSL están relacionados con la prevalencia relacionada con la edad de la metilación del ADN en la mucosa colónica junto con la presencia de la mutación BRAF. SSA/SSP/SSL tiende a crecer más rápidamente que los adenomas convencionales y están sobrerrepresentados como lesiones precursoras en cánceres colorrectales intervalares (CRC diagnosticados dentro de los 60 meses posteriores a una colonoscopia negativa).
Los HPs son distintos de otros pólipos serrados en que tradicionalmente no se han considerado con potencial para transformarse en cáncer. Aunque el término "adenoma" sigue evitándose, ahora se reconoce que los HPs pueden albergar oncogenes y pueden no ser siempre tan inocuos como se pensaba anteriormente. Subconjuntos de HPs pueden volverse displásicos o transformarse en SSA/SSP/SSL y comportarse como lesiones precursoras. Los pólipos que se transforman tienen una alta prevalencia de la mutación BRAF.
Clínicamente, los HPs se consideran de alto riesgo si son múltiples, grandes (>10 mm), displásicos, o si ocurren en el contexto de un historial familiar de síndrome de poliposis serrada (SPS).
Síndrome de Poliposis Serrada (SPS)
El SPS ha sido descrito y se asocia con un exceso de riesgo de CCR en el probando y en los familiares de primer grado, aunque aún no se ha establecido un patrón claro de heredabilidad.
El SPS se caracteriza por la presencia de múltiples pólipos serrados. Es el síndrome de poliposis más común y tiene una prevalencia mucho mayor que la FAP. La edad media al momento del diagnóstico (45 años) es más joven que la de los pacientes con SSA/SSP/SSL (57 años) que no cumplen con los criterios para SPS.
Dada la ausencia de cualquier marcador genético, un diagnóstico de SPS se define por la OMS de la siguiente manera:
- Un total de por vida de >20 pólipos serrados de cualquier tamaño (≥5 proximales al recto), o
- Un total de por vida de ≥5 lesiones/pólipos serrados proximales al recto, todos con al menos 5 mm de tamaño, con al menos dos midiendo >10 mm
Un diagnóstico de SPS en individuos con cualquier tipo de pólipo serrado que tengan un historial familiar de SPS había sido considerado un criterio diagnóstico, pero fue abandonado por la OMS en 2019.
SPS conlleva un alto riesgo de malignidad, y se han reportado cánceres colorrectales concurrentes en hasta un 15% - 30% de los pacientes al momento del diagnóstico. Aunque hasta un 70% de los pacientes con SPS cumplirán sus criterios diagnósticos en la primera colonoscopia de detección cuando se descubre, pueden pasar años y varias colonoscopias para acumular suficientes pólipos para un diagnóstico confirmado. Esto puede resultar en una subdiagnóstico de SPS, aunque los riesgos asociados con la falta de reconocimiento temprano pueden mitigarse tratando cada pólipo serrado individual con cuidado y de acuerdo con las directrices de vigilancia aceptadas actualmente.
El riesgo global de malignidad con SPS puede ser tan alto como del 30% - 70% (en comparación con el 100% para FAP), pero el riesgo a cinco años disminuye al 1% una vez que un individuo diagnosticado ingresa a programas de vigilancia. Aún no se ha identificado ningún marcador genético de línea germinal a pesar del riesgo elevado de CRC en familiares de primer grado (riesgo relativo = 5).
Las Implicaciones de la Displasia en Informes Histológicos
La displasia describe las apariencias patológicas que reflejan características anormales de crecimiento celular que no alcanzan el estado de cáncer. La displasia resulta del daño al ADN y se considera una progresión hacia la transformación cancerosa, o bien puede indicar que la transformación a cáncer podría haberse establecido. Aunque algunos argumentan que, por definición, cualquier neoplasia o nuevo crecimiento celular no característico es algún grado de displasia, las células de los adenomas pueden tener una morfología histológica básicamente normal y, por lo tanto, no se describen como displásicas.
En los informes de patología, las lesiones del colon generalmente se describen como no displásicas o asociadas con grados bajo, intermedio o alto de displasia. El grado de displasia en los pólipos predice sus resultados e influye en las recomendaciones de vigilancia. Las severidades crecientes de displasia reflejan una proliferación celular aberrante creciente y son expresión de la adquisición secuencial de oncogenes malignos.
Los pólipos pequeños (<10 mm) contienen solo las primeras alteraciones genéticas, y solo un pequeño número de estos desarrollarán o adquirirán los cambios genéticos adicionales necesarios para estimular una división celular acelerada no controlada, marcada displasia y el desarrollo de cáncer.
La displasia de alto grado (o severa) (HGD) ahora abarca las mismas características histológicas que el carcinoma in situ (CIS). Algunas autoridades han abandonado el término "CIS" y en su lugar utilizan el término "lesiones epiteliales en el tracto gastrointestinal", y "HGD" ha reemplazado a "CIS" en algunas declaraciones de médicos asistentes. La displasia de alto grado solo se encuentra en <10% de adenomas convencionales y adenomas serrados sésiles en poblaciones de riesgo promedio, lo que refleja que la mayoría de los pólipos no se convierten en cáncer.
Tamizaje inicial de pólipos colorrectales
Los protocolos de detección de pólipos colorrectales varían según el país y la autoridad y continúan evolucionando. En individuos de bajo riesgo sin síntomas, enfermedad inflamatoria intestinal ni antecedentes familiares de cáncer, generalmente se recomienda comenzar el tamizaje entre los 45 y 50 años de edad.
Las modalidades de detección recomendadas para individuos de riesgo promedio incluyen:
- Prueba anual de sangre oculta en heces (SOH) (incluidas las pruebas de SOH basadas en guayaco de alta sensibilidad)
- Prueba anual de sangre en heces inmunológica (FIT)
- Colonoscopía cada 10 años
- Prueba de ADN en heces de múltiples blancos cada tres años
Vigilancia después de la resección de pólipos
Los protocolos actualizados para la vigilancia en personas con un pólipo índice han sido publicados y están disponibles en línea a través de la European Society of Gastrointestinal Endoscopy (ESGE) (2020), el Cancer Council de Australia (2019) y el U.S. Multi-Society Task Force on Colorectal Cancer (2020).
En términos generales, las recomendaciones de vigilancia después de la resección de pólipos en individuos de riesgo promedio están influenciadas por los siguientes aspectos del pólipo:
- Histología (adenoma convencional vs pólipo serrado)
- Tamaño
- Número
- Presencia o ausencia de displasia
- Arquitectura villosa vs lisa
Si bien los pólipos de bajo riesgo pueden no requerir una vigilancia aumentada (regreso a intervalos regulares de cribado), otros pueden necesitar colonoscopias repetidas en intervalos más cortos.
Para hombres con pólipos de bajo riesgo, se pueden recomendar intervalos de cinco años si tienen síndrome metabólico.
Conclusión
El cáncer colorrectal (CRC) es el segundo tipo de cáncer más común diagnosticado y la tercera causa principal de mortalidad relacionada con el cáncer, a pesar de las oportunidades de detección que son insuperables en oncología en términos de efectividad comprobada. A medida que la detección se hace más accesible y adoptada con mayor frecuencia, los aseguradores deben reconocer la alta prevalencia de pólipos y comprender su potencial maligno. Aunque la detección cuidadosa con seguimiento de vigilancia puede reducir la incidencia y mortalidad por CRC, el aumento en las tasas de colonoscopias está generando presión adicional sobre los servicios médicos.
Las directrices de detección continúan enfatizando la importancia de exámenes de alta calidad, con resecciones realizadas y pacientes seguidos con cuidado y rigor. La garantía de que se logrará un resultado deseado después de la resección de pólipos detectados durante las detecciones requiere comprender la clasificación y el comportamiento de los pólipos, así como tener un dominio de los procedimientos involucrados.
Finalmente, la evaluación del riesgo de individuos con lesiones precancerosas de alto riesgo debe realizarse con referencia a la patología de las lesiones índice descubiertas y asegurando que se implementen y sigan protocolos de vigilancia adecuadamente adaptados a las circunstancias individuales.
El autor desea agradecer a la Dra. Radhika Counsell, Oficial Médico Consultor de RGA, por su revisión por pares de este artículo.


