El sistema inmunológico humano desempeña un papel vital en la protección del cuerpo contra infecciones, sustancias nocivas y cambios celulares como el cáncer.
El fortalecimiento del sistema inmune para tratar cánceres se describió por primera vez a finales del siglo XIX, cuando el Dr. William B. Coley descubrió que los sarcomas de tejidos blandos y huesos podían ser controlados en algunos pacientes al inyectarlos directamente con bacterias inactivadas por calor. (Estas más tarde se conocieron como “toxinas de Coley”.2)
Los enfoques más recientes del tratamiento para el cáncer han utilizado mediadores de respuesta inmune como la interleucina y vacunas dirigidas, pero con éxito limitado.
Una perspectiva más efectiva desarrollada durante los últimos 20 años ha sido mejorar la capacidad de las células inmunes y en particular los linfocitos T o células T, para reconocer, dirigirse y eliminar células tumorales. Han surgido dos vías principales: los inhibidores de puntos de control inmunológicos, que trabajan activando las células T; y la terapia CAR T-cell, que modifica y mejora la función del receptor de células T.
El camino de la inmunoterapia contrasta con la quimioterapia y las terapias biológicas o dirigidas, que funcionan atacando funciones celulares vitales para matar células cancerosas. Existe un reconocimiento creciente de la importancia del microambiente tumoral para el desarrollo y progresión del cáncer. El perfil de efectos secundarios de la inmunoterapia es diferente al de la quimio o las terapias dirigidas, por lo que puede ofrecer una mejor calidad de vida a las personas con cánceres avanzados que se someten a dichos tratamientos.
Este artículo revisa cómo la inmunoterapia moderna está transformando los resultados del cáncer, y la posibilidad real de que incluso pueda curar algunos altamente letales, como el melanoma maligno.
Sistema inmunológico
Los dos componentes principales del sistema inmunológico son los sistemas innato y adaptativo. Ambos trabajan juntos para proteger el cuerpo contra el ataque de agentes dañinos.
El sistema inmunológico innato está compuesto por células dendríticas y macrófagos, es decir, células que presentan antígenos. Estas patrullan el cuerpo y engullen cualquier antígeno extranjero o proteínas asociadas con patógenos y células cancerosas. Estos son luego presentados a las células T (linfocitos T), que son el componente principal del sistema inmunológico adaptativo.
Las células T son un tipo de glóbulo blanco. Se originan a partir de células madre en la médula ósea y maduran en el timo en uno de los tres tipos de células: células T auxiliares, células T citotóxicas y células T reguladoras. Estas células pueden residir en los tejidos periféricos o circular en la sangre o el sistema linfático. Basado en la naturaleza de la glucoproteína en la superficie celular, las células T citotóxicas también se conocen como células CD8+ y las células T auxiliares como células CD4+.18
La activación de las células T auxiliares desencadena una cascada que permite al sistema inmunológico erradicar células que llevan un antígeno extranjero. Están involucrados en la estimulación de las células T citotóxicas para que se proliferen y ataquen, y en la estimulación de los linfocitos B (células B) para que se proliferen y maduren en células plasmáticas que producen anticuerpos.19
Las células T reguladoras (también conocidas como TREG) pueden suprimir la respuesta inmunitaria y, por lo tanto, tienen un papel crítico en la prevención de la autoinmunidad. Su función es inhibir la proliferación de las células T y la producción de citocinas.
El sistema inmunológico adaptativo reconoce y recuerda patógenos específicos para crear inmunidad duradera. Las células T llevan receptores únicos para detectar antígenos específicos.
Biología-Inhibidores de Puntos de Control Inmunológicos
Para prevenir la autoinmunidad, es decir, un ataque de las propias células inmunes de una persona a sus autoantígenos, el sistema inmunológico humano tiene varios puntos de control clave que apagan las respuestas de las células T. En un cuerpo sano, esta regulación inhibitoria de las células inmunes también puede minimizar el daño tisular colateral al controlar la duración y la extensión de una respuesta inmune.
Ciertas células cancerosas pueden sobrevivir y continuar proliferando al aprovechar las vías de los puntos de control inmunitario para evadir la detección y destrucción por parte del sistema inmunológico. Los medicamentos de inmunoterapia anteriores se dirigían a las proteínas de puntos de control inmunitario PD-1 y CTLA-4 en las células T, y los enfoques modernos de la inmunoterapia del cáncer utilizan anticuerpos que, en esencia, bloquean moléculas específicas de puntos de control inmunitario.
La Figura 1 muestra la vía de muerte celular programada (PD). (La muerte celular programada, o apoptosis, es un proceso fisiológico normal.) El receptor en la superficie de la célula T se llama PD-1. El ligando (o proteína) que se une a este receptor se llama PD-L1 (ligando de muerte programada 1). PD-L1 puede estar presente tanto en células cancerosas como en células normales.
En ciertos cánceres, cuando el receptor PD-1 de una célula T se conecta con el ligando PD-L1 de una célula cancerosa, la célula T se “apaga”, lo que significa que no atacará a la célula tumoral a pesar de poder detectarla. Es como si la célula cancerosa se hubiera vuelto invisible para la célula T. Las terapias con inhibidores de puntos de control inmunológico funcionan rompiendo esa vía de puntos de control inmunológico, ya sea bloqueando el receptor PD-1 o el ligando PD-L1, permitiendo así que las células T se activen.
FIGURA 1:
BLOQUEO TUMORAL DE CÉLULAS T
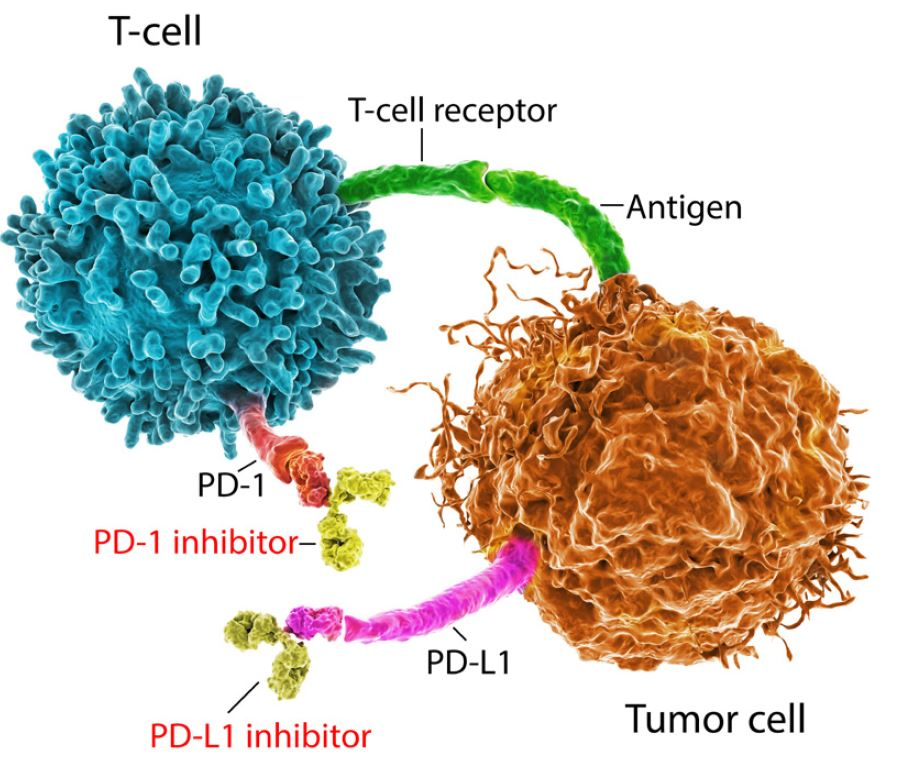
Inhibidores de Puntos de Control Inmunológicos en el Melanoma Maligno
Las terapias con inhibidores de puntos de control inmunológico actúan como bloqueos para la proliferación de células cancerosas. Han revolucionado el tratamiento de una serie de cánceres; en particular el melanoma maligno.
El melanoma metastásico es un cáncer altamente letal con una tasa de supervivencia a cinco años de no mejor que el 20% al 30%.3 Los melanomas en sitios viscerales como el hígado y el cerebro tienen el peor pronóstico, con expectativas de vida promedio de menos de un año.4
Ensayos recientes de ciertos inhibidores de puntos de control inmunológicos están dando resultados interesantes. El ensayo clínico CheckMate-067, por ejemplo, ha estado estudiando el medicamento anti-PD-1 nivolumab y el medicamento anti-CTLA-4 ipilimumab como posibles tratamientos para el melanoma maligno avanzado en pacientes previamente no tratados. El ensayo reclutó a 945 pacientes con cánceres en etapa 3 (diseminación a los ganglios linfáticos) y etapa 4 (diseminación a sitios distantes). Los participantes fueron agrupados en tres brazos: uno recibió terapia combinada de nivolumab e ipilimumab; uno recibió solo nivolumab; y uno recibió solo ipilimumab. Los pacientes en cada uno de los brazos recibieron cuatro cursos de tratamiento seguidos de mantenimiento con nivolumab hasta que experimentaron progresión de la enfermedad o eventos adversos intolerables.
Como se muestra en la Tabla 1, casi dos tercios de los pacientes que recibieron nivolumab tuvieron respuestas en curso cinco años después de comenzar el tratamiento, ya sea administrado con ipilimumab o por sí solo. Alrededor de una quinta parte de este grupo de pacientes también experimentó una respuesta completa (remisión), sin signos de cáncer en las exploraciones después de completar el tratamiento.
Muchos de los que recibieron terapia combinada también experimentaron un control largo y sostenido de sus cánceres, con tasas de supervivencia mediana de más de cinco años después de comenzar el tratamiento. Estos son resultados notables de un ensayo clínico bien conducido y sugieren que puede ser posible curar algunos melanomas avanzados.
Una desventaja de la terapia con inhibidores del punto de control inmunológico es que los eventos adversos son comunes. La razón de esto es que al dirigirse a una proteína de punto de control, las células T se activan y pueden atacar células en todo el cuerpo, incluyendo la piel, intestino, hígado, pulmón, riñón y glándulas endocrinas. Aunque los eventos adversos pueden ser de moderados a graves (grado 3 y grado 4), rara vez son potencialmente mortales y generalmente se resuelven dentro de las 12 semanas de comenzar el tratamiento.
| Tabla 1: Resultados del ensayo CheckMate 067 20 | |||
|---|---|---|---|
| Nivolumab + Ipilimumab | Nivolumab alone | Ipilimumab alone | |
| Respuesta continua a los cinco años | 62% | 61% | 40% |
| Tasa de respuesta completa | 22% | 19% | 6% |
| Supervivencia media (meses) | >60 | 36.9 | 19.9 |
| Eventos adversos – Grados 3 (moderado grave) y 4 (grave) | 59% | 23% | 28% |
Eficacia de los inhibidores del punto de control inmunológico
En los últimos diez años, las inmunoterapias han transformado los resultados para muchos pacientes con cánceres en etapa avanzada. Esto no solo ha sido para los melanomas malignos, sino también para los cánceres de pulmón, cabeza y cuello, mama, renal y de vejiga. De hecho, muchos pacientes con cáncer de etapa 4 que recibieron tratamientos de inmunoterapia han logrado respuestas duraderas y expectativas de vida significativamente mejoradas.21
Una desventaja de la inmunoterapia, sin embargo, es que muchos pacientes no responden a ella. De hecho, solo se estima que el 12% de todos los pacientes con cáncer se beneficiarán del tratamiento con inhibidores del punto de control inmunológico.5 Aún así, se están desarrollando varios nuevos medicamentos de inmunoterapia y se están planeando ensayos clínicos para una amplia gama de tipos de cáncer.
Aunque los efectos secundarios de los medicamentos inhibidores del punto de control, que pueden incluir estreñimiento/diarrea, fatiga, tos, náuseas, dolor muscular/articular y más, no son cómodos, son mejor tolerados que los de la quimioterapia. Sin embargo, existe la posibilidad de que los efectos secundarios sean graves, lo que resulta en una menor calidad de vida e incluso en la muerte. Actualmente se está haciendo un esfuerzo considerable para identificar biomarcadores predictivos que indiquen quién puede responder bien a estos tratamientos y para quién pueden tener poco o ningún beneficio.
La experiencia clínica también sugiere que factores como la carga mutacional del tumor, la deficiencia de reparación de desajustes y los niveles de expresión de PD-L1 pueden indicar la eficacia potencial del tratamiento. Sin embargo, en este momento, no hay biomarcadores fiables para seleccionar a los pacientes para el tratamiento.6 Dicho esto, se recomienda obtener los niveles de expresión de PD-L1 en las guías de tratamiento para el cáncer de pulmón de células no pequeñas.
Carga mutacional del tumor
La carga mutacional del tumor (TMB) es el número de mutaciones en el ADN de una célula cancerosa.22 El cáncer se caracteriza por la proliferación continua de células. Esto generalmente comienza con mutaciones genéticas que ocurren al azar durante el proceso de replicación del ADN para la división celular. Las mutaciones genéticas tienen el potencial de producir proteínas anormales, que pueden ser expresadas por las células como antígenos del cáncer. Cuanto mayor sea el número de mutaciones, mayor será la probabilidad de que las células generen antígenos que puedan desregular los puntos de control inmunológico en las células T. Esta hipótesis ha sido respaldada por un análisis de más de 1,600 pacientes con una variedad de cánceres, incluyendo melanoma maligno, cáncer de pulmón de células no pequeñas y cáncer de vejiga.
Se ha asociado una mayor carga mutacional del tumor con una mayor supervivencia y mejores tasas de respuesta a las terapias con inhibidores del punto de control inmunológico. Sin embargo, no parece haber un punto de corte predictivo común para todos los tipos de cáncer, lo que significa que la utilidad clínica de predecir la respuesta a la terapia es incierta.7
Deficiencia en la reparación de desajustes
La vía de reparación de desajustes juega un papel clave en la identificación y reparación de bases desajustadas durante la replicación del ADN. El proceso de reparación evita las inserciones o eliminaciones de ADN anormal en los microsatélites (secuencias cortas repetidas de ADN). Los defectos o deficiencias en este proceso, conocidos como reparación deficiente de desajustes (dMMR), resultan en altos niveles de inestabilidad de microsatélites (MSI-H) y acumulación de mutaciones de ADN dentro de la célula. Los tumores con dMMR se denominan con alta TMB.
Los defectos de los genes MMR pueden deberse a mutaciones germinales, como se ve en ciertos cánceres hereditarios como el síndrome de Lynch, o pueden ocurrir espontáneamente. Los pacientes con síndrome de Lynch son susceptibles a desarrollar múltiples cánceres, especialmente de colon y endometrio. El dMMR ocurre en aproximadamente el 15% de los casos de cáncer de colon esporádico.8
Actualmente, hay numerosos ensayos clínicos de pembrolizumab, un medicamento de inmunoterapia que se dirige al PD-1 en una variedad de cánceres dMMR avanzados que se han vuelto resistentes a la quimioterapia. En general, aproximadamente el 40% de los pacientes en estos ensayos obtuvieron algún beneficio del tratamiento de inmunoterapia. Las respuestas duraron más de seis meses en el 78% de los pacientes, con un rango de 1.6 a 27 meses.9 Estos resultados llevaron a la FDA de los EE. UU. a aprobar el pembrolizumab para el tratamiento de los cánceres dMMR/MSI-H inoperables o metastásicos como segunda línea o terapia posterior, independientemente del sitio o tipo de cáncer.
Expresión de PD-L1
Los puntos de control PD-1/PD-L1 tienen funciones importantes en el mantenimiento de la tolerancia inmunológica. Estos puntos de control también son secuestrados por las células cancerosas para evitar la detección y destrucción por parte del sistema inmunológico. En el cáncer de pulmón de células no pequeñas metastásico, los inhibidores del punto de control inmunológico que utilizan ya sea una bloqueo de PD-1 o PD-L1 están ahora incorporados en las mejores prácticas terapéuticas, ya que los ensayos clínicos han mostrado un doble de las tasas de supervivencia media con esta inmunoterapia.
La serie de ensayos clínicos Keynote se centra en el pembrolizumab como inhibidor del punto de control inmunológico y se están llevando a cabo para una amplia gama de cánceres, con resultados destacados hasta la fecha. El ensayo clínico Keynote-024, que prueba el pembrolizumab en cánceres con alta expresión de PD-L1 (al menos 50%), encontró que la terapia casi duplicó la supervivencia media a 26.3 meses en comparación con los 13.4 meses de la quimioterapia.10
El ensayo clínico Keynote-189, que se centró en pacientes con cáncer que expresaban niveles intermedios de PD-L1 (1-49%), demostró que agregar pembrolizumab a la quimioterapia en el cáncer avanzado de pulmón no microcítico metastásico mejoró la tasa de supervivencia al año del 49% al 69%. La supervivencia a los dos años también aumentó, pasando del 27% al 46%.11
A pesar de la utilidad de PD-L1 como biomarcador para guiar la selección del tratamiento para el cáncer de pulmón no microcítico, una revisión de estudios que respaldaron la aprobación de la FDA de inhibidores del punto de control inmunológico en una variedad de cánceres destacó la falta de consistencia en la metodología, como el tipo de ensayo utilizado, el tipo de célula estudiada (tumoral, inmune o ambas) y los valores de corte de expresión para definir el nivel de expresión. La revisión también informó que los valores positivos de PD-L1 predijeron una mejor respuesta a la inmunoterapia en menos del 30% de los estudios.12
Terapia de células CAR-T
Las células CAR-T son otro tipo de tratamiento contra el cáncer basado en la inmunoterapia. CAR, o receptor de antígeno quimérico, es una proteína sintética diseñada para las células T que les permite detectar un antígeno específico en una célula cancerosa.
La Figura 2 muestra el proceso de laboratorio y clínico de varias semanas para proporcionar terapia CAR-T autóloga. Las células T de la sangre de un paciente se aíslan mediante aféresis, un proceso en el que las células se separan del plasma. Luego, las células T se convierten en células CAR-T mediante la inserción de un gen que codifica para CAR. Después de permitir que las células CAR-T resultantes se multipliquen, se infunden nuevamente en el paciente.
Se ha denominado a la terapia de células CAR-T como un “medicamento vivo”, ya que estas células T modificadas son estables, continúan multiplicándose en el cuerpo y pueden detectar y erradicar las células cancerosas si reaparecen más adelante en el tiempo. Se planea como un tratamiento único con efectos duraderos.
La FDA de Estados Unidos y el Instituto Nacional de Excelencia Clínica del Reino Unido (NICE) han aprobado el uso de la terapia de células CAR-T para la leucemia linfoblástica aguda de células B (LLA) en personas de hasta 25 años y para adultos con tres tipos de cáncer de sangre: linfoma difuso de células B grandes; linfoma mediastínico de células B; y linfoma del manto. El tratamiento se puede administrar cuando el cáncer de sangre es refractario al tratamiento de primera línea o ha recidivado después de al menos dos líneas de terapia.
FIGURA 2:
PROCESO PARA LA TERAPIA AUTÓLOGA DE CÉLULAS CAR-T
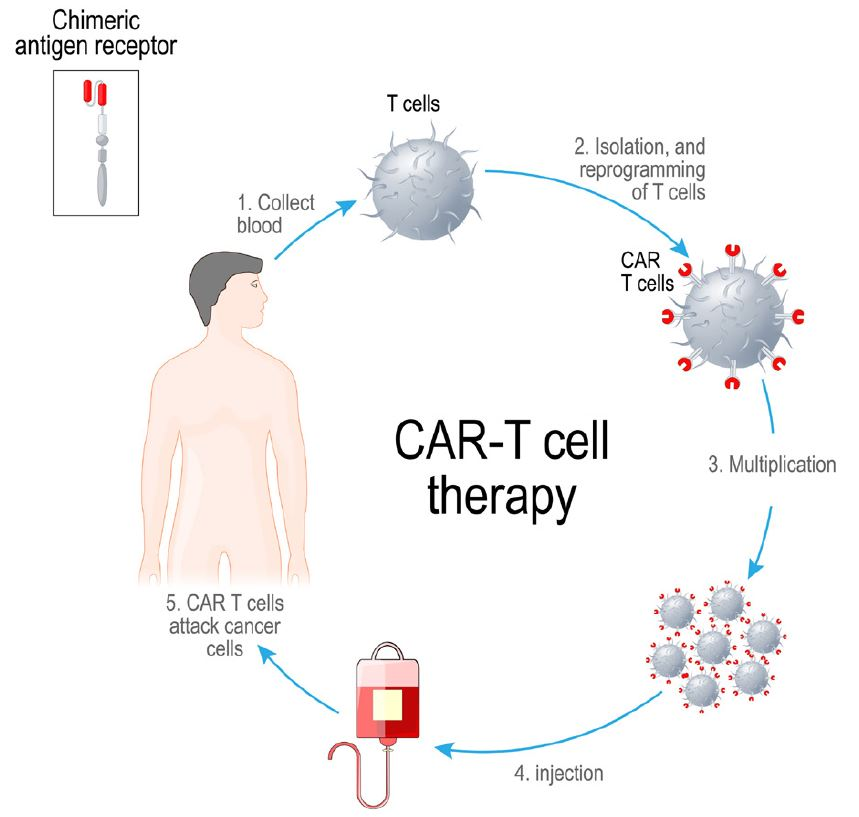
Antígeno quimérico superior
- Recolección de sangre
Células T
- Aislamiento y reprogramación de las células T
- Células CAR-T
- Multiplicación
- Terapia de células CAR-T
- Inyección
- Las células CAR-T atacan las células cancerosas
La terapia de células CAR-T fue aprobada por primera vez por la FDA para uso clínico en 2017. Informes clínicos iniciales indicaron una tasa de respuesta completa superior al 80%,13 y algunos pacientes que han recibido este tratamiento lograron una remisión sostenida de más de tres años.14 Se está llevando a cabo un seguimiento a largo plazo para definir con mayor precisión la duración de la respuesta y para determinar si los pacientes pueden ser curados en realidad.
Las indicaciones clínicas para la terapia de células CAR-T son los cánceres sanguíneos, ya que su uso en tumores sólidos está limitado por factores como los microambientes de los tumores sólidos, que impiden que las células CAR-T alcancen las células cancerosas objetivo, la expresión de antígenos tanto por células cancerosas como por células normales, y la expresión variable de antígenos dentro de un paciente específico, que incluso pueden estar ausentes en muchas células.15
Costo de la terapia de células CAR-T
A pesar de los resultados espectaculares obtenidos con la terapia de células CAR-T, se ha criticado por su costo muy elevado. Actualmente, cada paciente recibe un tratamiento personalizado basado en el antígeno tumoral expresado. El costo por tratamiento puede variar, dependiendo del país, desde 0,5 millones de dólares estadounidenses hasta 1 millón de dólares estadounidenses.
La terapia con células CAR alógenas, o “listas para usar”, puede ser una alternativa menos costosa. Esto implica el uso de células T de donantes sanos y el uso de herramientas de edición genética en lugar de un virus para alterar el ADN de las células T y producir la terapia con células CAR-T.
Efectos adversos inmunológicos
Las proteínas inhibidoras de los puntos de control inmunológico desempeñan un papel vital en la prevención de la autoinmunidad. Sin embargo, el bloqueo terapéutico de los receptores inhibidores también puede romper la tolerancia inmunológica propia (la capacidad de un sistema inmunológico para reconocer antígenos producidos por el propio organismo como no amenazantes), lo que puede llevar a efectos secundarios indeseables. Los pacientes tratados pueden desarrollar una amplia gama de enfermedades autoinmunes que afectan al intestino, la piel, la glándula pituitaria y tiroides, el páncreas, los pulmones, el hígado, las articulaciones, los riñones y el sistema hematopoyético.16 Afortunadamente, los síntomas suelen ser autolimitados, aunque ciertas afecciones de la piel pueden tardar en resolverse y algunos pacientes con efectos secundarios relacionados con el sistema endocrino pueden requerir reemplazo hormonal a largo plazo.
Con la terapia de células CAR-T, después de la infusión de las células T modificadas, puede haber liberación de grandes cantidades de citocinas, los mensajeros químicos que orquestan la respuesta inmunológica.17 Este síndrome de liberación de citocinas está asociado con altas temperaturas y una disminución de la presión arterial. Aunque estos síntomas pueden ser graves, se pueden manejar con éxito con esteroides y medicamentos antiinflamatorios.
Este síndrome también puede desencadenar una cascada inflamatoria dentro del cerebro, causando confusión grave, convulsiones y deterioro del habla. La aparición de diferentes grados de síndrome de neurotoxicidad asociado a células efectoras inmunes, conocido por ocurrir en los días y semanas posteriores a la administración de terapias que involucran células efectoras inmunes y células T, es común, pero generalmente se resuelve en siete a diez días. La mortalidad es infrecuente y, cuando ocurre, se debe a edema cerebral difuso.
Investigaciones actuales
Un enfoque novedoso adicional para la inmunoterapia centrada en el cáncer es la terapia con virus oncolíticos. Se sabe que ciertos virus tienen la capacidad de infectar y destruir las células cancerosas. Cómo funciona: el virus infecta o penetra en una célula y se apodera del ADN de la célula para hacer copias de sí mismo. Actualmente, una versión genéticamente modificada del virus del herpes simplex es la única aprobada por la FDA para tratar el melanoma.23
Después de la infección con un virus oncolítico, los antígenos cancerosos se liberan de las células cancerosas moribundas, lo que estimula al sistema inmunológico a atacar y destruir cualquier célula cancerosa restante cerca y potencialmente en cualquier otra parte del cuerpo. El virus puede ser modificado genéticamente para que tenga menos capacidad de infectar células sanas.
Según el sitio web cancer.gov del Instituto Nacional de Salud de los Estados Unidos, los virus oncolíticos actualmente se están evaluando en ensayos clínicos. Los resultados preliminares son alentadores, pero se necesitará más investigación con ensayos clínicos controlados y aleatorizados para expandir el uso de esta terapia.
Impacto en los productos de seguros
Estas terapias, aunque relativamente nuevas, ya están teniendo impacto en la industria de seguros.
Ventajas
- Retraso en reclamos por enfermedades terminales (ET) debido a una mayor esperanza de vida.
- Reducción en reclamos por ET si algunos cánceres avanzados son curados.
- Es posible que se otorguen seguros de vida a solicitantes con ciertos tipos de cáncer avanzado.
- Reducción de los beneficios anuales para titulares de anualidades con discapacidad.
Desventajas
- Períodos de beneficio más largos para las anualidades con discapacidad.
- Los costos de los seguros de salud pueden aumentar sustancialmente debido al alto costo de estos tratamientos.
Conclusión
En la última década, los nuevos enfoques descubiertos para utilizar inmunoterapias en la lucha contra el cáncer han cambiado drásticamente los resultados de los tratamientos tanto para tumores sólidos como para ciertos cánceres sanguíneos. A diferencia de la quimioterapia y las terapias biológicas, que matan directamente las células cancerosas atacando las vías celulares vitales involucradas en la proliferación y el crecimiento, la inmunoterapia se dirige a las células T. Los inhibidores de los puntos de control inmunológico activan las células T, mientras que la terapia de células CAR-T modifica las células T para mejorar su eficacia como combatientes del cáncer.
Algunos pacientes que reciben tratamientos de inmunoterapia están logrando remisiones sostenidas a largo plazo, lo que plantea la posibilidad de que ahora sea posible curar algunos cánceres altamente letales. Sin embargo, se estima que solo alrededor del 12% de los pacientes con cáncer se beneficiarán de la inmunoterapia. Aunque parece que los biomarcadores como la alta carga mutacional de tumores (TMB), la inestabilidad de microsatélites y la expresión de PD-L1 están asociados con la eficacia de la inmunoterapia, no son consistentemente confiables en todos los tipos de cáncer para ser predictivos. Sin embargo, existe un considerable interés en continuar realizando ensayos clínicos para dilucidar el lugar de la inmunoterapia en el tratamiento del cáncer y el uso de biomarcadores para la selección y el monitoreo de la terapia.





